炎症性サイトカイン産生における小胞体ストレスセンサーの役割の解明
−新規の炎症制御薬開発への手がかり−

| 発表日時 | 博狗体育平台_博狗体育在线-集团网站6年4月11日(木) 11時30分~12時00分 |
|---|---|
| 場所 | 生涯研修センター研修室 |
| 発表者 |
本学医学部 先端医学研究所 生体調節機構研究部 |
発表資料ダウンロード
概要
インフラマソームと呼ばれるタンパク質複合体は、病原体感染の際には、マクロファージからの炎症性サイトカインインターロイキン-1β (intrerleukin-1β: IL-1b)の産生に関与し、防御応答に必須の役割を果たす。しかし、インフラマソーム機能が過剰になると、自己炎症性疾患、糖尿病?動脈硬化など様々な慢性炎症性疾患の発症、病態の増悪を来す。今回、我々はマウスマクロファージの解析により、小胞体ストレスセンサーIRE1αがインフラマソーム機能に必須の役割を果たしていること、すなわち、炎症性サイトカイン産生を制御する新規の分子基盤を明らかにした。本研究成果は、様々な炎症性疾患の病態解明および新規制御薬の開発に貢献することが期待される。
1. 背景
マクロファージは病原体を貪食すると共に、様々な炎症性サイトカインを産生し炎症反応を引き起こす。インターロイキン-1β(intrerleukin-1β: IL-1b)は、マクロファージが産生する代表的な炎症性サイトカインであり、まず、病原体センサーであるToll様受容体などの刺激によりIL-1β前駆体遺伝子の発現が亢進し、IL-1β前駆体タンパク質として産生される。しかし、このIL-1β前駆体は炎症誘導活性を持っていない不活性型であり、インフラマソームにより切断されてはじめて活性型のIL-1bとして炎症誘導活性を発揮できるようになる。インフラマソームは、病原体センサー、タンパク質切断酵素(プロカスパーゼ-1)、およびその両者を連結させるアダプター分子ASCから構成され、病原体センサーの名前を冠してNLRP3インフラマソームやパイリンインフラマソームなどと呼称され、そのセンサーが認識する刺激に応答し機能する。インフラマソームは、病原体由来の構成成分や毒素ばかりでなく、生体内の代謝産物である尿酸、コレステロール、膵島由来ペプチドにも応答することにより、微生物感染への防御反応や、痛風?動脈硬化?糖尿病などの炎症性疾患の病態形成にも関与している。また、インフラマソームの構成因子の遺伝子変異(バリアント)により、クリオピリン関連周期熱症候群や家族性地中海熱などの自己炎症性疾患が生じることもわかってきている。さらに、コレステロール経路の代謝酵素(メバロン酸キナーゼ)や細胞内タンパク質輸送を制御する機能分子(Cdc42)などインフラマソーム以外の機能分子の遺伝子バリアントによっても、インフラマソームが活性化され、自己炎症性疾患を来すことがわかってきて、新規のインフラマソーム制御機構が明らかになりつつある。このように、インフラマソームの活性化は様々な病態に関与しているが、その分子細胞基盤に関してはまだよくわかっていない。
我々はこれまで、コレラ菌由来の毒素、コレラ毒素の免疫増強(免疫アジュバント)機能に着目し、その作用機構にインフラマソームが関与することを明らかにしてきた(Int Immunol. 31:657-668, 2019)。コレラ毒素は、腸管上皮細胞に作用し下痢を引き起こすAサブユニットと、細胞膜上の糖脂質ガングリオシドGM1(以下、GM1)に結合しコレラ毒素を細胞内に導入させるBサブユニットから構成されている。コレラ毒素は、マウスの腹腔に常在するマクロファージ(以下、腹腔マクロファージ)に作用し、リポ多糖と協調してIL-1bの産生を誘導するが、このIL-1bの産生誘導に、NLRP3、パイリンを病原体センサーとして含む2つのインフラマソームが関与する。しかし、コレラ毒素がどのようにインフラマソームを活性化するのかは不明なままであった。
今回、我々は、これまでの研究を進め、腹腔マクロファージにおいて、コレラ毒素がGM1依存的に小胞体に侵入、蓄積し、小胞体ストレス応答を誘導すること、そして小胞体ストレスセンサーIRE1αがNLRP3インフラマソームやパイリンインフラマソームの刺激によるIL-1b産生誘導に必要であることを明らかにした。すなわち、本研究により、組織常在マクロファージにおいてストレスセンサーと病原体センサーが連関して炎症性サイトカインを産生するという新規分子機構が示唆されたのでここに報告する。
2. 研究手法?結果
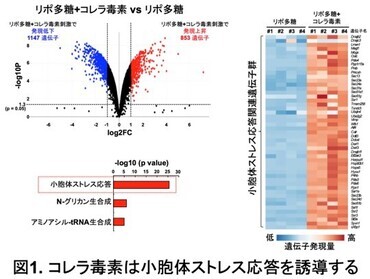
まず、リポ多糖で刺激した腹腔マクロファージにおいて、コレラ毒素により誘導される遺伝子群の網羅的解析(RNAシークエンス) を行った(図1)。その結果、コレラ毒素の刺激で2倍以上発現が上昇する遺伝子が853個得られ、その中には小胞体ストレス応答により誘導される遺伝子が数多く含まれていた。この結果から、コレラ毒素が小胞体ストレス応答を誘導することが明らかになった。
タンパク質は合成された後、小胞体で正しく折りたたまれ、機能する。正しく折りたたまれず異常な構造を取ったタンパク質や、細胞に取り込まれた毒素が小胞体内で蓄積すると、PERK やIRE1αなどの小胞体ストレスセンサーが活性化され、タンパク質の分解処理や合成停止に関与する機能分子群の遺伝子発現が亢進するなど、小胞体ストレス応答とよばれる経路が活性化される。
そこで、コレラ毒素による小胞体ストレス応答の誘導に、糖脂質GM1を介した小胞体内への侵入が必要かどうか、GM1欠損マウスを用いて解析した(図2)。
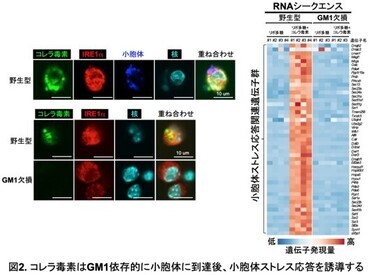
野生型腹腔マクロファージでは、コレラ毒素が小胞体内へ侵入し、小胞体ストレス応答遺伝子群の発現が顕著に誘導されたが、GM1欠損腹腔マクロファージでは、コレラ毒素は小胞体内には検出されず、小胞体ストレス応答遺伝子群の発現も全く認められなかった。すなわち、コレラ毒素は糖脂質を介して小胞体内へ侵入、蓄積し、小胞体ストレス応答を誘導していることが明らかになった。
次に、小胞体ストレスセンサーPERK とIRE1αのどちらがIL-1b産生誘導に関与するかを明らかにするため、それぞれのセンサーの阻害剤を用いて検討した (図3)。コレラ毒素によるIL-1b産生誘導は、PERK阻害剤の添加により影響を受けなかったが、IRE1α阻害剤の添加により、顕著に阻害された。さらに、生体内でのIRE1αの役割を明らかにするために、マクロファージ特異的にIRE1αを欠損するマウスを作製した。
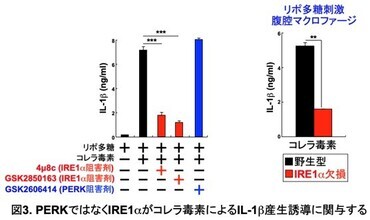
そして、IRE1α欠損腹腔マクロファージを解析したところ、コレラ毒素によるIL-1b産生誘導が障害されていた。このように、コレラ毒素で刺激された腹腔マクロファージにおける小胞体ストレス応答の誘導にはIRE1αが必須であることが明らかになった。
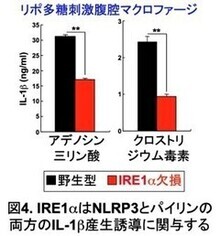
コレラ毒素は、NLRP3、パイリン両方のインフラマソームを活性化する。そこで、IRE1αがどちらのインフラマソーム活性に関与しているのか明らかにするために、IRE1α欠損腹腔マクロファージを用いて、NLRP3インフラマソームの活性化因子アデノシン三リン酸、パイリンインフラマソームの活性化因子クロストリジウム毒素それぞれのIL-1b産生誘導能を解析した(図4)。その結果、アデノシン三リン酸、クロストリジウム毒素いずれのIL-1b産生誘導能も障害されることが明らかになった。この結果から、小胞体ストレスセンサーIRE1αは、NLRP3、パイリン両方のインフラマソームの活性化に関与していると考えられた(図5)。
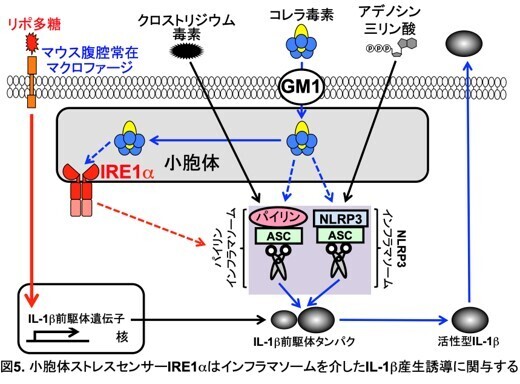
3. 波及効果
インフラマソームの活性化機構は、これまで主にヒトマクロファージ細胞株や、マウス骨髄細胞を培養して得られるマクロファージを用いて解析されてきているが、組織に常在するマクロファージに焦点を当てた研究はほとんど行われていない。また小胞体ストレス応答機構も、細胞株を用いた研究を中心に分子基盤が明らかになりつつあるが、組織に常在するマクロファージにおける役割は不明なままであり、パイリンインフラマソームとの関連性は全く検討されていない。
本研究で着目したマウス腹腔常在マクロファージは、生物種を超えて保存されており、ヒトの腹腔にも対応するマクロファージが常在している。今回、このマクロファージからの炎症性サイトカインの産生に小胞体ストレスセンサーが関与するという新規の分子基盤が明らかになったことから、今後この観点から、種々の慢性炎症性疾患や自己炎症性疾患の病態解明が進み、新規の炎症制御薬の開発に繋がることが期待される。
4. 特記事項
本研究成果は、2024年3月22日、国際学術誌Cell Reports (オンライン版)に掲載されました。
タイトル: A stress sensor, IRE1α, is required for bacterial-exotoxin-induced interleukin-1b production in tissue-resident macrophages
著者名:Izumi Sasaki*, Yuri Fukuda-Ohta, Chihiro Nakai, Naoko Wakaki-Nishiyama, Chizuyo Okamoto, Daisuke Okuzaki, Shuhei Morita, Shiori Kaji, Yuki Furuta, Hiroaki Hemmi, Takashi Kato, Asumi Yamamoto, Emi Tosuji, Shin-Ichiroh Saitoh, Takashi Tanaka, Katsuaki Hoshino, Shinji Fukuda, Kensuke Miyake, Etsushi Kuroda, Ken J. Ishii, Takao Iwawaki, Koichi Furukawa, and Tsuneyasu Kaisho*(*責任著者)
本研究は、科学研究費補助金研究 学術変革領域研究(A)『生体防御における自己認識の「功」と 「罪」』における研究課題「細胞内タンパク質変動による自己応答制御機構の解明」(JP22H05187、研究代表者 改正恒康、研究分担者 佐々木泉)、基盤研究(B)「抗原提示細胞の機能的分化を制御する分子基盤の解明」(JP20H03505、研究代表者 改正恒康)、基盤研究(C)「細胞内輸送関連分子により制御される炎症性サイトカイン産生誘導の新規分子機構の解明」(JP22K07006、研究代表者 佐々木泉)、公益財団法人 武田科学振興財団(研究代表者 改正恒康)などの支援を受け、和歌山県立医科大学にて実施されました。
PDFファイルをご覧になるには、Adobe AcrobatReaderが必要です。
Adobeより無償でダウンロードできます。

